Chi sono i protagonisti del microbiota neonatale?
A livello vaginale, sotto la spinta degli estrogeni il microbiota si arricchisce in lattobacilli; questo crea una stabilità vaginale essenziale per contrastare le infezioni in gravidanza. Per la sua complessità il microbiota intestinale rappresenta la nicchia dove avvengono i cambiamenti più importanti durante la gestazione. Questo è quanto dimostrato nella review Microbial Changes during Pregnancy, Birth, and Infancy, pubblicata su Frontiers in Microbiology.
In un primo momento la donna si arricchisce in proteobatteri, specie batteriche Gram-negative e contemporaneamente si impoverisce in Faecalibacterium produttore di butirrato.
Da questo ne deriva un aumento dell’infiammazione subclinica, un aumento della permeabilità intestinale e una riduzione della diversità, parametri che ricordano condizioni tipiche dei soggetti in sindrome metabolica.
Questi cambiamenti, infatti, devono consentire alla donna in gravidanza di avere uno sviluppo metabolico e un adeguamento immunitario che preservino la prole.
Solo durante l’ultimo periodo della gestazione la donna esplode in Actinobacteria, phylum interamente costituito da bifidobatteri. Questo genere microbico ha un compito fondamentale nel neonato che verrà partorito per via vaginale e allattato al seno.
Il microbiota della mamma viene realmente trasferito al neonato?
Nella review pubblicata di recente sull’importante rivista American Society for Microbiology The First Microbial Colonizers of the Human Gut: Composition, Activities, and Health Implications of the Infant Gut Microbiota i ricercatori hanno sviscerato in maniera dettagliata le caratteristiche generali del microbiota infantile, come questo viene “costruito” e come influisce sullo stato di salute del neonato e del bambino.
Di particolare importanza il capitolo sul trasferimento del microbiota materno-fetale che risponde alla domanda: Esiste effettivamente un trasferimento da madre a figlio del consorzio microbico?
Lo studio conclude che la colonizzazione microbica del tratto intestinale del neonato sano inizia durante e subito dopo la nascita per trasmissione verticale dal microbiota materno. In particolare, il microbiota intestinale materno influenza la costituzione del microbiota infantile e di conseguenza lo stato di salute del neonato.
Da un punto di vista batterico, un neonato rappresenta un’isola essenzialmente disabitata, dove ai primi colonizzatori viene offerta una scelta di opzioni di insediamento, creando così opportunità o restrizioni per il gruppo successivo di batteri colonizzatori. La colonizzazione del tratto gastrointestinale del neonato sano (nato a termine per via vaginale e allattato al seno) avviene principalmente per trasmissione verticale, in primis dal passaggio vaginale e successivamente rinforzato dall’allattamento al seno. Purtroppo, quando il feto è partorito tramite taglio cesareo e/o allattato con formula, mancando la prima colonizzazione, la composizione del microbiota intestinale del neonato risentirà prevalentemente dell’ambiente.
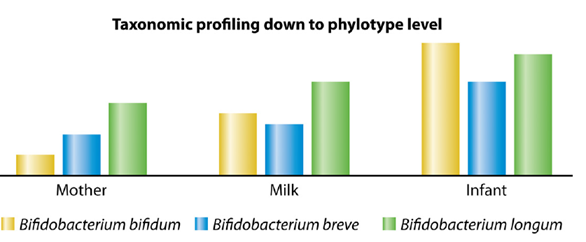
Anche in questa review viene evidenziata una popolazione microbica presente sempre nella coppia madre-neonato: proteobatteri e bifidobatteri. In particolare, i bifidobatteri possono rappresentare oltre il 50% dell’intero microbiota intestinale neonatale. La triade Bifidobacterium breve, Bifidobacterium longum e Bifidobacterium bifidum si osserva nelle madri e nei loro figli.
Tra tutti i bifidobatteri, quale specie risulta protagonista nel neonato?
I bifidobatteri sono presenti nel microbiota intestinale sano dell’uomo per tutta la sua vita ed è interessante notare come si modifichi la predominanza di alcune specie in base all’età. Nei primi due anni di vita, il B. breve e il B. bifidum, seguiti come numero dal B. longum subsp. infantis, rappresentano la triade dominante del neonato, soprattutto se allattato al seno. Nell’adulto i bifidobatteri si riducono di numero e le specie maggiormente presenti sono il B. adolescentis e il B. longum.
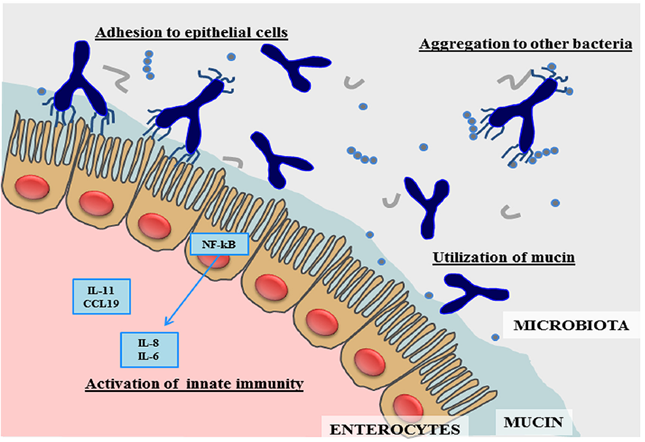
Dei tre bifidobatteri che dominano il microbiota del neonato nei primi due anni di vita, il Bifidobacterium bifidum è la specie che ha suscitato il maggior interesse dei ricercatori. Questo batterio è tra i primi a colonizzare il microbiota nei primi giorni di vita del neonato e risulta fondamentale per il suo corretto sviluppo e per “adattare” il sistema immunitario agli stimoli esterni, portandolo alla giusta maturità del bambino sano. La principale caratteristica che distingue il B. bifidum dagli altri commensali del microbiota intestinale è la sua capacità peculiare nel degradare i carboidrati complessi presenti nel latte materno (HMO) rendendoli disponibili a tutto il consorzio microbico che li utilizza come prebiotici, favorendo in questo modo la biodiversità intestinale. Altra caratteristica di questa specie è la sua capacità di degradare i glicani della mucina, che rappresentano i componenti principali dello strato di muco che ricopre la superficie epiteliale intestinale, fungendo da barriera protettiva. La degradazione della mucina da parte del B. bifidum stimola un meccanismo di feedback che induce gli enterociti ad aumentare la produzione di mucina e di conseguenza lo strato di muco-barriera intestinale. Questa condizione è così importante che in diversi studi viene dimostrata come la carenza di muco intestinale, sia nel bambino che nell’adulto, risulti un fattore che accomuna i soggetti affetti da sindrome dell’intestino irritabile. Siccome nel microbiota intestinale la specie B. bifidum dopo i primi anni tende quasi a scomparire, la capacità di utilizzare il muco in modo efficiente è una caratteristica che nei soggetti adulti viene effettuata da un altro batterio chiamato Akkermansia muciniphila.
Quali sono le caratteristiche del Bifidobacterium bifidum?
Nella review Bifidobacterium bifidum as an example of a specialized human gut commensal, viene analizzata l’importanza di questo batterio per il corretto sviluppo del microbiota umano e le sue caratteristiche principali che lo differenziano dagli altri bifidobatteri.
Una caratteristica tipica del B. bifidum è la presenza di strutture piliformi che fuoriescono dalla sua superfice. Questi pili svolgono un ruolo importante nel processo di colonizzazione e non solo. Aumentano l’adesione agli enterociti dell’uomo e favoriscono l’aggregazione tra batteri facilitando la crescita delle colonie di tutti i batteri commensali. L’altro aspetto molto importante è l’interazione di questi pili con il sistema immunitario; questi, infatti, vanno a modulare il rilascio di TNF-α, citochina che esercita un ruolo importante nella risposta immunitaria alle infezioni intestinali e non solo. È stato dimostrato che l’interazione tra B. bifidum ed epitelio intestinale, a differenza di altre specie batteriche, provoca un aumento significativo della produzione di IL-17 modulando l’attività delle cellule linfocitarie regolatorie (Treg). Questo porta ad ipotizzare che tale batterio abbia un ruolo chiave nello sviluppo della tolleranza immunitaria e di conseguenza della sua corretta maturità. Il B. bifidum svolge un ruolo da protagonista anche nell’attenuare la risposta infiammatoria modulando le IL-6 e IL-8 attraverso l’attivazione di NF-kB.
Ad oggi in letteratura sono evidenziati solo due ceppi di B. bifidum (PRL2010 e MIMBb75) che hanno avuto un buon successo nell’essere coltivati e di conseguenza abbiamo a disposizione diversi studi che ne dimostrano l’attività. Nella seguente review i ricercatori concludono che il B. bifidum rappresenti la specie che esercita un ruolo importante nell’evoluzione e nella maturazione del sistema immunitario che durante i primi anni di vita del bambino risulta ancora sottosviluppato. Questa caratteristica fa di questo batterio un componente fondamentale per la salute del bambino e di conseguenza dell’adulto. Gli studi su questo batterio spingono il suo uso come probiotico per migliorare lo stato di salute dei neonati, nella prevenzione e nel trattamento della sua disbiosi intestinale.