
La Matrice ExtraCellulare: il mezzo attraverso cui si muovono le bioinformazioni
Il percorso dove si muovono le bioinformazioni è la matrice extracellulare, MEC, un sistema a tre stadi: stadio solido, stadio fluido e stadio di contatto con le membrane cellulari.
È composta da proteine di adesione, come proteoglicani PG e glicosaminoglicani GAG, proteine strutturali, come fibre elastiche e collagene, e liquido interstiziale (acqua e suoi soluti).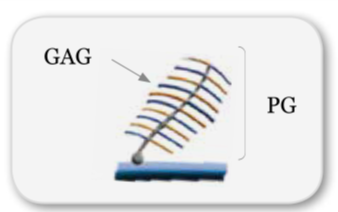
GAG, PG e liquido interstiziale formano un gel dalla consistenza gelatinosa che può essere più o meno solidificabile a seconda delle condizioni fisiologiche e patologiche dell’organismo cui appartiene.
Può infatti stabilizzarsi o passare rapidamente da uno stato di maggiore soluzione (SOL) ad uno di maggiore addensamento (GEL) con spazi più stretti tra le cellule.
I GAG e i PG, per la loro rapida capacità di effettuare cambiamenti strutturali, grazie alla loro parte saccaridica di differenziarsi, di legarsi all’acqua e scambiare ioni, rappresentano i supporti perfetti per l’eliminazione dei fotoni non coerenti e la diffusione di quelli coerenti.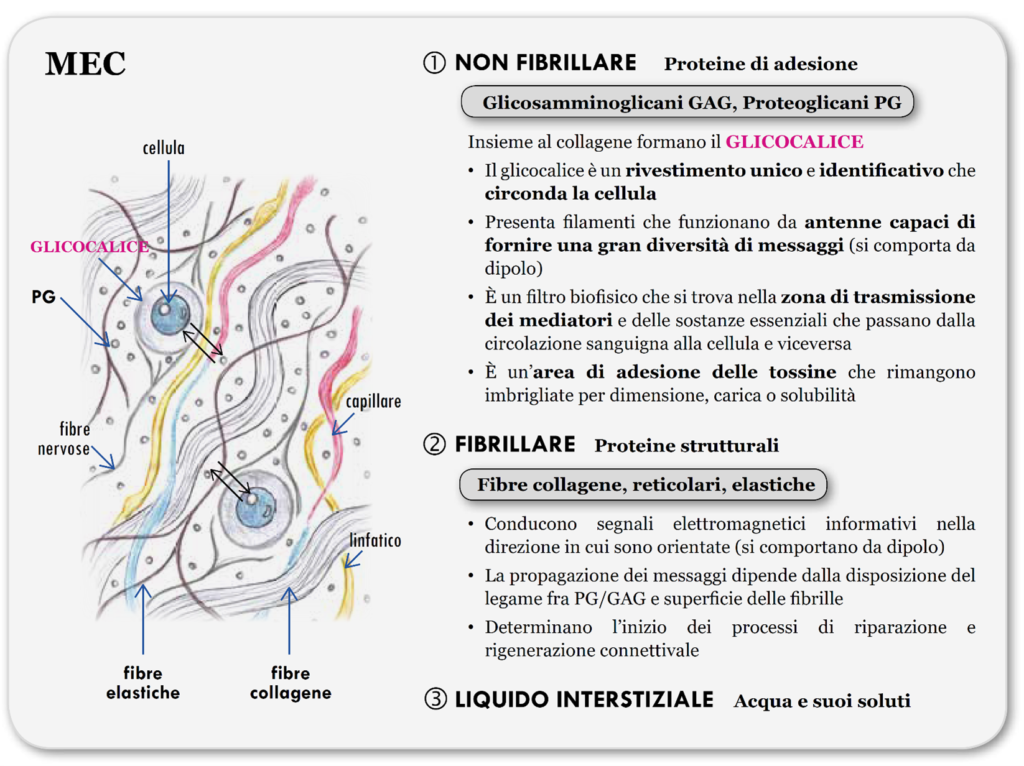
Glicocalice e matrisomi
I GAG e i PG possono essere liberi negli spazi extracellulari oppure essere connessi alle membrane cellulari a formare il glicocalice, essenziale per la differenziazione e il mantenimento degli organismi pluricellulari, è importante per l’ancoraggio della cellula all’ambiente extracellulare, per l’identificazione cellulare e per l’adesione intracellulare.
Il glicocalice è il portale della comunicazione biofisica tra la cellula e il comparto extracellulare: la parte saccaridica dei GAG/PG fluttua nella matrice con il compito biofisico di distinguere e selezionare gli impulsi elettrodinamici, la bioinformazione, che debbono transitare, in entrata ed in uscita, attraverso la membrana cellulare.
PG, GAG, proteine reticolari, glicoproteine strutturali e strutture vincolate temporaneamente come citochine, fattori di crescita, proteasi, metaboliti, cataboliti formano i matrisomi, strutture connettivali collegate l’una con un’altra. Sono singole unità ripetitive, costruite come piccole reti arrotolate dalle dimensioni frattali, assemblate e smontate velocemente, con periodi di 10-9/10-5 secondi, capaci di cambiare continuamente per adattarsi alle bioinformazioni.
I matrisomi mostrano internamente dei tunnel nei quali i biofotoni verrebbero scagliati nel mezzo verso il loro target. A passaggio avvenuto vengono smontati molto velocemente e così la dispersione energetica è minima ed il messaggio più diretto e selettivo.
La matrice, essendo il luogo dove avvengono i primi contatti con unità esogene e dove si possono incontrare tutte le bioinformazioni, si adatta ai messaggi biofisici, per rispondere a stress patologici o fisiologici, secondo due modelli organizzativi:
- i fibroblasti producono proteine più strutturali, diminuiscono gli ioni liberi, la matrice diviene più densa, gli spazi extra-cellulari divengono più stretti, l’acqua si organizza in clusters con minori escursioni oscillatorie. In questo substrato la bioinformazione scorre con difficoltà;
- le proteine strutturali tendono allo smantellamento, la matrice diviene più fluida, l’acqua è caratterizzata da movimenti maggiormente cinetici, sono presenti molti più ioni liberi, gli spazi extra-cellulari sono più ampi e così la bioinformazione scorre più facilmente.
L’acqua biologica interstiziale, il conduttore della bioinformazione
La MEC comprende anche il liquido interstiziale costituito da ACQUA e suoi soluti.
La struttura dell’acqua può essere influenzata nei suoi legami dalle molecole in soluzione che ne modificano il comportamento mostrando configurazioni stechiometriche nuove anche a distanza dal soluto.
In questo modo le molecole d’acqua sono in continuo cambiamento di stato e, quindi, in continuo movimento vibratorio che la rendono capace di attrarre, produrre e riprodurre biomessaggi sia propri che provenienti da altre strutture. Quindi la struttura dell’acqua può essere modificata anche da una molecola disciolta in essa, configurandosi in modo nuovo in base alle informazioni con cui è venuta a contatto.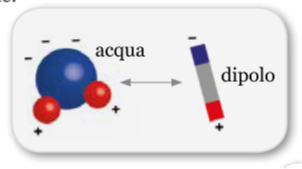
Tali modifiche si mantengono piuttosto stabili se persistono le stesse condizioni che le hanno create. Ogni molecola d’acqua è un dipolo che cede protoni ad altre due molecole d’acqua e ne ricevere da altre due. Essendo i protoni sono divisi fra due atomi di ossigeno, si modificano di continuo variando i loro rapporti fra energia libera e energia nei legami con produzione di un incessante movimento vibratorio.
A livello biologico le molecole di acqua possono comportarsi anche da isolanti e, cioè, collegarsi in catene tramite legami idrogeno, con ossigeno libero, e formare, così, una strada attraverso cui protoni H+ possono saltare da un atomo di ossigeno ad un altro (jumping protonico) coprendo distanze significative all’interno o attorno alle strutture macromolecolari, senza perdita di calore. In pratica, l’acqua biologica fornisce un «rivestimento dinamico» che realizza una minore dispersione della informazione.
L’acqua inoltre può strutturarsi in clusters, o clatrati, grappoli di molecole cristalliformi pentagonali o esagonali che si uniscono e si organizzano come una rete circondando cavità vuote o contenenti macromolecole, frammenti di macromolecole o molecole. La regolare organizzazione dei clusters si deve alla sequenziale disposizione dei legami idrogeno.
I clatrati sono in grado di produrre oscillazioni coerenti in risonanza con i campi magnetici delle strutture chimiche che racchiudono e poi di diffondere all’esterno i biomessaggi che provengono da queste. L’acqua biologica interstiziale conduce quindi la bioinformazione che sembra continuare ad essere inviata anche quando la molecola che la genera non c’è più.
DNA srotolato, il produttore intracellulare della bioinformazione endogena
La bioinformazione prodotta dalle strutture viventi ha come risonatore chiave intracellulare la catena del DNA. Popp ha dimostrato infatti che la massima emissione biofotonica proviene dal DNA endonucleare in fase di srotolamento quando viene stimolato da imputs esterni selezionati dalla membrana cellulare e nucleare. Solo la parte coerente dei biofotoni liberati si dirige verso vari targets nel nucleo, nel citoplasma e verso la membrana cellulare esterna che agisce da filtro fisico e chimico delle informazioni in uscita e in entrata. La prova di questo fatto fu data da M. Rattemeyer ed A. Popp con il seguente esperimento: una sostanza colorante, il bromuro di etidio (BE), ha la caratteristica di legarsi avidamente alla catena del DNA e provocarne lo srotolamento; l’entità di tale srotolamento è direttamente proporzionale alla concentrazione del BE. Quando, però, lo srotolamento dell’elica di DNA è giunto al termine, l’ulteriore aggiunta di BE provoca il riarrotolamento dell’elica ma nel senso opposto.
Supponendo che il DNA fosse la fonte maggiore di produzione fotonica, gli sperimentatori valutarono l’emissione fotonica in rapporto alla concentrazione di BE e videro che vi era un aumento di emissione fotonica con l’aumento della concentrazione di BE fino a quando si raggiungeva il massimo dello srotolamento dell’elica del DNA; a questo punto, con l’ulteriore aggiunta di BE, l’emissione fotonica diminuiva e questo era in accordo con il fatto che l’elica ricominciava a riarrotolarsi.
Un altro esperimento importante fu quello eseguito presso il centro ricerche mediche dell’Università di Novosibirsk: due palloni di vetro contenenti delle colture di fibroblasti di cui una infettata da un virus, venivano unite tra di loro attraverso un diaframma, inizialmente di vetro mentre, in seguito, venne sostituito da quarzo e permeabile ai fotoni.
Fino a che il diaframma era costituito da vetro, le colture si comportavano indipendentemente l’una dall’altra, solo quando il diaframma fu sostituito da una lastra di quarzo si vide che la coltura di fibroblasti non contaminata dal virus iniziava a manifestare delle lesioni tipiche dell’infezione.
Due sono i dati importanti: il primo è che l’esperimento fu ripetuto 10.000 volte e risultò positivo nell’80% dei casi; il secondo è che dei segnali patogeni mediati da radiazioni ultraviolette (fotoni) sono penetrati nell’ampolla attraverso il quarzo, stimolando lo sviluppo della coltura sana senza trasmissione di virus o particelle.
Il percorso intracellulare ed extracellulare della bioinformazione
La bioinformazione endogena coerente proveniente dal DNA endonucleare in fase di srotolamento è frutto del corredo cromosomico, è l’espressione fisica di ogni sistema biologico ed è in grado di attivare in modo ordinato e altamente specializzato qualsiasi procedura chimica e fisica e di confrontarsi con qualsiasi informazione esogena.
Questi biomessaggi, disposti in fasci di fotoni coerenti che si susseguono l’uno all’altro, si dirigono in parte verso il nucleo stesso per coordinare la risposta ed in parte entra nel sistema reticolare endoplasmatico, lungo tunnel nel quale il treno fotonico prende velocità, fino ad arrivare alla membrana cellulare che, avendo una struttura isolante, li obbliga a dirigersi verso i glicocalici, vie di uscita verso l’extracellulare.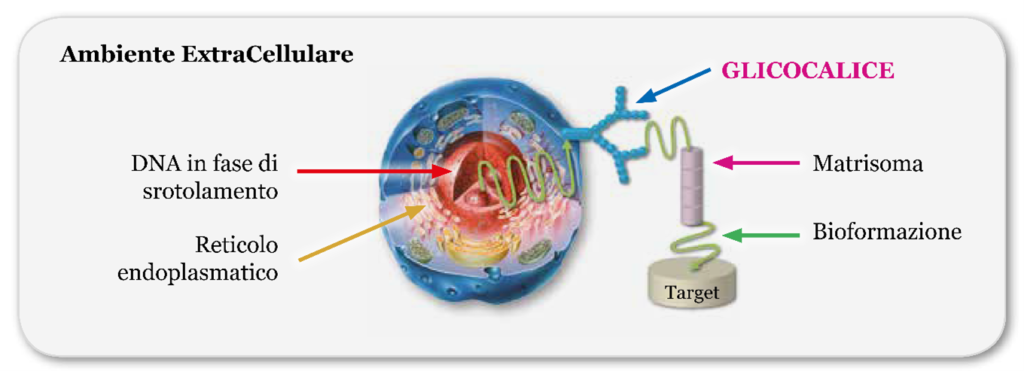
Nella matrice vengono assemblati i matrisomi a seconda delle necessità della bioinformazione e al loro interno i biofotoni viaggiano nel mezzo, la matrice, verso i loro bersagli, posti anche a grande distanza.
La matrice è, quindi, principalmente un grande organo ubiquitario di relazione.
In caso di GEL del sistema, tipico delle flogosi croniche, i messaggi viaggiano meno rapidamente mentre, in caso di SOL del sistema, tipico delle flogosi acute, essendo le cellule più distanti, i fibroblasti ed i macrofagi sono attivati a smantellare le proteine strutturali, le molecole di acqua tendono a muoversi più rapidamente e ad organizzarsi meno in clusters ed i messaggi viaggiano in modo più diretto e rapido.
Bibliografia
1 Boyd LJ. A Study of the Simile in Medicine, Philadelphia: Boericke and Tafel, 1936Schulz H. Uber die Theorie der Arzneimittelwirkung. Virchows Archiv 1877; 108: 423-434
2 Schulz H. Uber Hefegifte Arch fuer Physiol 1888; 42: 517-541
3 Martius F. Das Arndt-Schulz Grundgesetz. Muench Med Wschr 1923; 70: 1005-1006
4 Oberbaum M, Cambar J. Hormesis: dose-dependent reverse effects of low and very low doses. In Ultra High Dilutions, edited by PC Endler and J Schulte. Dordrecht: Kluwer Acad Publ, pp. 5-18, 1994
5 Townsend JF, Luckey TD. Hormoligosis in pharmacology. J Am Med Ass 1960; 173: 44-48
6 Stebbing ARD. Hormesis: the stimulation of growth by low levels of inhibitors. Sci Tot Environ 1982; 22: 213-234
7 Furst A. Hormetic effects in pharmacology: pharmacological inversions as prototypes for hormesis. Health Phys 1987; 52: 527-530
8 Calabrese EJ, McCarthy ME, Kenyon E. The occurrence of chemically induced hormesis. Health Phys 1987; 52: 531-541
9 Linde K, Jonas WB, Melchart D, et al. Critical review and meta-analysis of serial agitated dilutions in experimental toxicology. Hum Exp Toxicol 1994; 13: 481-492
10 Bastide M. Immunological examples on ultra high dilution research. In Ultra High Dilutions, edited by PC Endler and J Schulte. Dordrecht: Kluwer Acad Publ, pp. 27-33, 1994
11 Bellavite P, Signorini A. Homeopathy, a Frontier in Medical Science. Controlled Studies and Theoretical Foundations. Berkeley: North Atlantic Books, 1995
12 Poitevin B, Davenas E, Benveniste J. In vitro immunological degranulation of human basophils is modulated by Lung histamine and Apis mellifica. Brit J Clin Pharmacol 1988; 25: 439-444
13 Sainte Laudy J, Belon P. Inhibition of human basophil activation by high dilutions of histamine. Agent Actions 1993; 38: C245-247
14 Sainte-Laudy J, Belon P. Analysis of immunosuppressive activity of serial dilutions of histamine on human basophil activation by flow cytometry. Inflamm Res 1996; 45 (S1): 33-34
15 Bellavite P, Chirumbolo S, Lippi G, et al. Homologous priming in chemotactic peptide stimulated neutrophils. Cell Biochem Funct 1993; 11: 93-100
16 Bellavite P, Chirumbolo S, Lippi G, et al. Dual effects of formylpeptides on the adhesion of endotoxin-primed human neutrophils. Cell Biochem Funct 1993; 11: 231-239
17 Bellavite P, Carletto A, Biasi D, et al. Studies of skin-window exudate human neutrophils. Complex patterns of adherence to serum-coated surfaces in dependence on FMLP doses. Inflammation 1994; 18:575-587
18 Iyengard R. Gating by cyclic AMP: expanded role for an old signaling pathway. Science 1996; 271: 461-463
19 Wiegant FAC, van Wijk R. Self-recovery and the similia principle: an experimental model. Complem Ther Med 1996; 4: 90-97
20 Wolff S. Are radiation-induced effects hormetic? Science 1989; 245: 57
21 Luckey TD. Low-dose irradiation. Advantage east! Radiat Protect Management 1993; 10: 59-63
22 Goldman M. Cancer risk of low-level exposure. Science 1996; 271: 1921-1822
23 Lapp C, Wurmser L, Ney J. Mobilization de l’arsenic fixe chez le cobaye sous l’influence des doses infinitesimales d’arseniate. Therapie 1955; 10: 625-638
24 Cambar J, Desmouliere A, Cal JC, et al. Mise en evidence de l’effet protecteur de dilutions homeopathiques de Mercurius corrosivus vis-a-vis de la mortalite au chlorure mercurique chez la souris. Ann Homeopathiques Fr 1983; 5: 160-167
25 Cazin JC, Cazin M, Gaborit JL, et al. A study of the effect of decimal and centesimal dilutions of Arsenic on the retention and mobilisation of Arsenic in the rat. Human Toxicol 1987; 6: 315-320
26 Palmerini CA, Codini M, Floridi A, et al. The use of Phosphorus 30 CH in the experimental treatment of hepatic fibrosis in rats. In: Omeomed92, edited by C Bornoroni. Bologna: Editrice Compositori, pp. 219-226, 1993
27 Ashby B. Novel mechanism of heterologous desensitization of adenylate cyclase: prostaglandins bind with different affinities to both stimulatory and inhibitory receptors on platelets. Molec Pharmacol 1990;38: 46-5
28 Sergeeva MG, Gonchar MV, Grishina ZV, Mevkh AT, Varfolomeyev SD. Low concentrations of nonsteroidal anti-inflammatory drugs affect cell functions. Life Sci 1995; 56: 313-31
29 Yankner BA, Duffy LK, Kirschner DA. Neurotrophic and neurotoxic effects of amyloid ? protein: reversal by tachykinin neuropeptides. Science 1990; 250: 279-282
30 Smith JA. Neutrophils, host defense, inflammation: a double-edged sword. J Leukocyte Biol 1994; 56: 672-677
31 Anggard E. Nitric oxide: mediator, murderer, medicine. Lancet 1994; 343: 1199-1206
32 Skerret PJ. Substance P causes pain, but also heals. Science 1990; 249: 625
33 Adams DO, Hamilton TA. Macrophages as destructive cells in host defense. In Inflammation, 2d edition, edited by J I Gallin, I M Goldstein and R Snyderman. New York: Raven Press, pp. 637-662, 1992
34 Metz SA, Halter JB, Robertson RP. Paradoxical inhibition of insulin secretion by glucose in human diabetes mellitus. J Clin Endocrin Metab 1979; 48: 827-835
35 Ludmer PL, Selwyn AP, Shook TL, et al. Paradoxical vasoconstriction induced by acetylcholine in atherosclerotic coronary arteries. N Engl J Med 1986; 315: 1046-1051
36 Griffin JH. The thrombin paradox. Nature 1995; 378: 337-338
37 Brain P, Cousens R. An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Res 1989; 29: 93-96
38 Van Ewijk PH, Hoekstra JA. Calculation of the EC50 and its confidence interval when subtoxic stimulus is present. Ecotoxicol Environ Safety 1993; 25: 25-32 Bibliografia Medicinali Omeopatici di Risonanza FM e FMS

