Ruolo clinico del ceppo Bifidobacterium longum W11 nei disturbi intestinali ed epatici
I bifidobatteri sono noti da tempo per la loro utilità come probiotici nel sanare forme di disbiosi intestinale.
La review del 2021 in via di pubblicazione, Bifidobacterium longum W11: uniqueness and individual or combined clinical use in association with rifaximin, illustra i risultati più rilevanti sull’efficacia clinica di Bifidobacterium longum W11 (LMG P-21586), ceppo probiotico utilizzato in ambito clinico per trattare vari disturbi intestinali ed epatici, è stato isolato da un donatore umano sano e il suo genoma è stato completamente sequenziato.
Caratteristiche del ceppo probiotico Bifidobacterium longum W11
Presenta tutte le caratteristiche adatte ad un probiotico:
- buona resistenza al pH gastrico e biliare
- ottima capacità di adesione alla mucosa intestinale, favorita dalla secrezione di esopolisaccaridi che ne aumenta di molto sia l’adesività che la possibilità di colonizzazione.
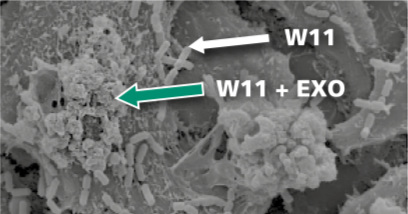 Inoltre, il contatto tra W11 e le cellule mononucleate del sangue periferico (PBMC) umane induce nell’ospite una risposta di tipo Th1, immunologicamente mirata a migliorare la capacità di contrastare i patogeni intracellulari: questa reazione è favorita da un aumento di IFN-γ e IL-2 e da una concomitante riduzione di IL-10, in assenza di conseguenze infiammatorie aspecifiche, come dimostrato dalla mancata induzione di TNF-α.
Inoltre, il contatto tra W11 e le cellule mononucleate del sangue periferico (PBMC) umane induce nell’ospite una risposta di tipo Th1, immunologicamente mirata a migliorare la capacità di contrastare i patogeni intracellulari: questa reazione è favorita da un aumento di IFN-γ e IL-2 e da una concomitante riduzione di IL-10, in assenza di conseguenze infiammatorie aspecifiche, come dimostrato dalla mancata induzione di TNF-α.
Senza dubbio, però, la caratteristica più notevole di B. longum W11 è la sua resistenza alla famiglia antibiotica delle rifamicine, rifaximina inclusa: ciò è dovuto ad una mutazione del polimorfismo nucleotidico nel gene rpoB.

Questa mutazione genetica si verifica in un tratto del genoma completamente privo di elementi genetici mobili, risultando quindi una caratteristica intrinseca e non trasferibile ad altri batteri, in conformità con le linee guida dell’EFSA. Questa resistenza specifica consente al ceppo B. longum W11 di essere consigliato in concomitanza alla rifaximina, per tutte quelle patologie trattate con rifaximina a cui comunque il clinico farebbe seguire un trattamento probiotico.
Ruolo clinico di B. longum W11 nell’IBS-C e nella stipsi funzionale
Una comprovata conseguenza della colonizzazione intestinale del B. longum W11 è una riduzione dei segni e sintomi di stitichezza, soprattutto se correlati a una diagnosi di IBS: un trial clinico eseguito su 636 soggetti con IBS-C trattati con Bifidobacterium longum W11, ha rilevato un aumento della motilità intestinale di circa il 25%, un aumento del numero di evacuazioni settimanali che si mantiene anche dopo l’interruzione del trattamento e una significativa riduzione dei segni e sintomi tipici dell’IBS. Risultati sovrapponibili sono stati ottenuti anche in un altro trial clinico su 129 soggetti, con una riduzione di circa il 40% del dolore addominale e del gonfiore intestinale. Tale ruolo anti-stipsi è stato confermato in uno studio effettuato su 300 donne nelle quali una dieta dimagrante ipocalorica aveva indotto un rallentamento della motilità intestinale: il B. longum W11 ha determinato un miglioramento statisticamente significativo nel numero di evacuazioni in circa il 30% dei soggetti in studio.
Ruolo clinico di B. longum W11 nella MHE e nella NASH
Rispetto all’iperammoniemia, nel contesto della variante più lieve dell’encefalopatia epatica nota come encefalopatia epatica minima (MHE), in cui i livelli di ammoniaca aumentati sono implicati nella patogenesi della malattia, il ceppo W11, in uno studio in doppio cieco, controllato con placebo, ha mostrato un’attività clinica significativa, con una riduzione del 54% nei livelli plasmatici di ammoniaca dopo 90 giorni di somministrazione.
Un ulteriore ruolo clinico importante per il ceppo W11 nelle malattie del fegato è stato dimostrato in pazienti con steatoepatite non alcolica (NASH), dove il trattamento con il ceppo W11 ha ridotto significativamente parametri come TNF-α, Proteina C-reattiva, AST, HOMA-IR, endotossina sierica, la steatosi e l’indice di attività della NASH, come rilevato dalla biopsia epatica.
Ruolo clinico di B. longum W11 nella SUDD, IBS, SIBO, enterocolite infettiva
Rispetto alla sua antibiotico-resistenza intrinseca alla rifaximina, un recente trial clinico ha dimostrato che la co-somministrazione di B. longum W11e rifaximina a 45 pazienti con malattia diverticolare sintomatica non complicata (SUDD) induce un miglioramento del 30% dello score sintomatologico oltre che triplicare la percentuale di pazienti con feci nella norma rispetto ai soggetti trattati con la rifaximina seguita dal trattamento col W11. La rifaximina, pur essendo considerato un antibiotico a carattere eubiotico, potrebbe comunque indurre cambiamenti nel microbiota intestinale, relativamente a parametri come la riduzione dell’α-biodiversità, con perdita di alcuni taxa poco espressi, e un probabile aumento del numero assoluto di batteri, soprattutto dei Gram-negativi. Pertanto, la somministrazione del ceppo W11 in contemporanea alla rifaximina per tutte quelle patologie in cui è consigliato tale antibiotico (iperammoniemia, malattia diverticolare, enterocolite infettiva, IBS, SIBO) potrebbe migliorare i risultati clinici prevenendo e limitando i possibili danni al consorzio batterico intestinale indotti dal farmaco.
Conclusioni
Dati recenti mostrano come un microbiota fortemente disbiotico possa essere correlato, o addirittura esserne la causa, a malattie che non sono necessariamente di natura intestinale, come l’aterosclerosi, l’ipertensione, la fibromialgia, e così via. La caratteristica di non-assorbibilità unita all’ampio spettro della rifaximina la renderebbero quindi l’antibiotico ideale per contrastare le specie batteriche la cui presenza caratterizza tali disbiosi. La decompensazione del microbiota disbiotico mediante somministrazione di rifaximina in associazione al B. longum W11 potrebbe costituire un nuovo approccio terapeutico per mitigare gli effetti negativi del trattamento antibiotico anche sulla componente “sana” del microbiota; ciò sarebbe utile per migliorare i risultati clinici derivanti dall’uso di rifaximina nel contrastare malattie cardiovascolari, neurologiche o osteoarticolari associate ad una evidente disbiosi.