Ruolo del microbiota intestinale nelle ricorrenze infettive urinarie
Milioni di donne ogni anno vengono colpite da infezioni acute del tratto urinario (UTI) e vengono trattate con antibiotici, ma almeno il 25% di loro subisce ricadute infettive frequenti che costringono ad eseguire più cicli di antibiotici.
Il fatto che circa il 50% delle UTI ricorrenti sia causato dallo stesso ceppo che ha causato l’infezione iniziale, suggerisce l’esistenza di un serbatoio associato all’ospite che non viene adeguatamente eliminato dai trattamenti attuali.
Lo studio “Establishing the role of the gut microbiota in susceptibility to recurrent urinary tract infections”, pubblicato nel 2022 su The Journal of Clinical Investigation, cerca di far luce sulle dinamiche degli uropatogeni all’interno dei serbatoi microbici associati all’ospite, nell’ottica di sviluppare opzioni di trattamento terapeutico e preventivo che limitino la morbilità, le ricorrenze infettive e il conseguente consumo di antibiotici.
Cause delle ricorrenze infettive urinarie
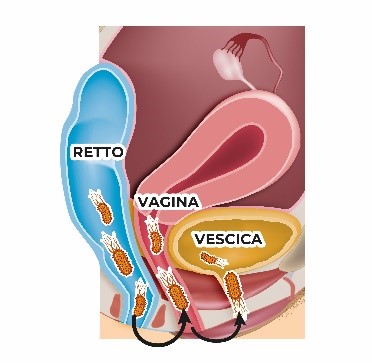
Le infezioni delle vie urinarie sono più comunemente causate dall’Escherichia coli uropatogeno (UPEC), che risiede nell’intestino e può risalire nel tratto urinario causando infezioni. La causa primaria risiede nei rapporti sessuali, che sono il principale fattore di rischio per le UTI.
Paradossalmente, però, anche l’uso di antibiotici in generale risulta essere un fattore di rischio significativo per le infezioni del tratto urinario, probabilmente a causa degli effetti deleteri dell’antibiotico sull’equilibrio del microbiota intestinale, dove risiede la maggior parte dei batteri uropatogeni.
Vari studi hanno dimostrato che la maggior parte degli UPEC sono residenti nell’intestino al momento dell’infezione e spesso rappresentano il ceppo di E. coli dominante nell’intestino.
Altri studi hanno esplorato sia il ruolo dell’ospite (tanto rispetto ai comportamenti sessuali e alle pratiche igieniche quanto alla sua genetica e al suo microbiota uro-genitale ed intestinale) sia il ruolo del patogeno (tanto rispetto al genotipo che al fenotipo quanto alla sua antibiotico-resistenza); sembra probabile che il livello di rischio di ricorrenza delle UTI derivi dall’integrazione delle caratteristiche di entrambi i sistemi biologici.
Ragionamenti sull’effettivo ruolo del microbiota intestinale nelle rUTI
I ricercatori dello studio in esame riflettono sui possibili ruoli modulatori dell’intestino e del suo microbiota rispetto alla suscettibilità verso le UTI ricorrenti (rUTI), per comprendere al meglio le interazioni che potrebbero stabilirsi lungo un ipotetico asse UPEC-intestino-microbiota.
Escludendo la probabilità che l’intestino funzioni esclusivamente come “spettatore” nella suscettibilità alle rUTI, grazie soprattutto agli studi che hanno identificato una ridotta diversità microbica e livelli più bassi di batteri butirrato-produttori nell’intestino delle donne con storia di rUTI rispetto ai controlli sani, l’ipotesi dell’intestino come “facilitatore” è quella che appare più vicina al vero.
Il concetto di “resistenza alla colonizzazione” ha guadagnato terreno negli ultimi anni, attraverso l’idea che un intestino perturbato e/o disbiotico possa essere più permissivo alla colonizzazione di agenti patogeni rispetto alla “resistenza” fornita da un microbiota sano e diversificato.
Stanno aumentando le prove che le perturbazioni del microbiota intestinale modulino la quantità, agendo sull’attività trascrizionale, e anche la virulenza degli UPEC; per esempio, si è dimostrato che diversi livelli di acidi grassi a catena corta (SCFA) possono regolare l’espressione di alcuni fattori di virulenza, come quelli per l’adesione degli UPEC alle cellule ospiti (fimbrie e pili) e quelli della motilità (flagelline).
Asse intestino-vescica: transito degli uropatogeni e sistema immunitario
Vari batteri commensali presenti nel microbiota intestinale si sono dimostrati in grado di influenzare direttamente la programmazione del sistema immunitario attraverso le interazioni con l’epitelio intestinale, e ciò porta a descrivere l’intestino anche come “agitatore” rispetto alla suscettibilità alle rUTI, specialmente qualora il suo microbiota sia carente di produttori di butirrato, acido grasso in grado di aumentare sia il livello delle citochine antinfiammatorie che stimolare la differenziazione dei linfociti Treg a livello sistemico.
Dunque, è lecito chiedersi se “l’asse intestino-vescica” comprenda non solo il transito diretto e ben caratterizzato dell’uropatogeno dall’intestino alla vescica, ma anche le interazioni indirette attraverso il sistema immunitario sistemico.
Futuri scenari nella profilassi delle rUTI
Le prove che il microbiota intestinale svolga un ruolo nella suscettibilità alle rUTI stanno aumentando e ciò apre nuovi obiettivi per il trattamento e la profilassi di queste patologie. Ciò che appare certo è che il trattamento antibiotico, oltre a sconfiggere gli uropatogeni, può causare perturbazioni significative e durature del microbioma intestinale, innescando un circolo vizioso che aumenta la suscettibilità a future infezioni.
La profilassi, pertanto, diventa fondamentale per evitare il più possibile il ricorso all’antibiotico; la si potrà attuare attraverso l’uso di molecole non antibiotiche, oppure di batteri probiotici capaci di produrle, che siano in grado di interferire con i fattori di virulenza dell’UPEC e sfavorire la presenza degli uropatogeni a livello intestinale, ma anche modulare il microbiota intestinale in senso antinfiammatorio e stimolare la corretta risposta immunitaria lungo l’asse intestino-vescica.

